引言
近來,由于三個部委明確要求所有出口的醫療用品必須要有藥品監督管理部門批準的醫療器械產品注冊證書才能驗放,所以許多最初希望通過自我聲明獲得醫用口罩CE認證的制造商開始將出口歐洲的注意力轉向防護口罩。 在歐盟防護口罩屬于個人防護用品PPE,需滿足法規(EU)2016/425的要求,并按照EN 149:2001 + A1:2009進行性能測試。
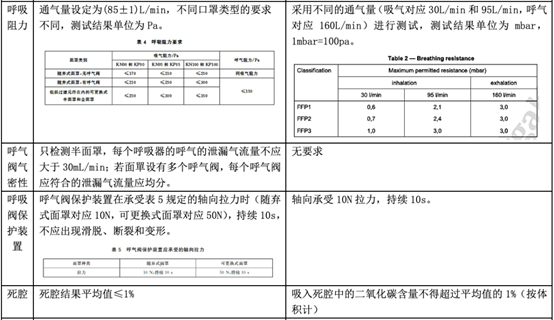
其實關于個人防護口罩,國內也有相對應的標準GB 2626-2019,但與EN 149沒有等效的轉換關系,那么兩者有什么區別呢?下面這張表格將從標準的適用范圍、基本要求、以及檢測項目幾個部分來為大家詳細解讀。
GB 2626-2019與EN 149:2001 + A1:2009之間的比較




總結
從上表可以知道,歐盟個人防護口罩測試標準EN 149:2001 + A1:2009和國內標準GB 2626-2019在測試項目和指標要求上有一定的相似性,如死腔,易燃性,清潔和消毒,實用性能和產品標識等。
但是由于GB 2626適用于三種類型的口罩,所以總體檢查項目將超過EN149。在某些指標(如:顆粒過濾效率)中,GB 2626的要求甚至高于EN 149(對于FFP1)。 因此,對于制造商來說,在提交給EN 149進行檢查之前,按照GB 2626進行性能測試是一個好的策略。













